Umumnya, rasio tetap ini harus tetap karena sifat fisikanya, bukan rasio yang dipilih manusia. Oleh karena itu, material seperti kuningan, superkonduktor YBCO, semikonduktor "aluminium galium arsenida", atau coklat dianggap sebagai campuran atau aloy, bukan senyawa.
Ciri-ciri yang membedakan senyawa adalah dia memiliki rumus kimia. Rumus kimia memberikan rasio atom dalam zat, dan jumlah atom dalam molekul tunggalnya (oleh karena itu rumus kimia etena adalah C2H4 dan bukan CH2. Rumus kimia tidak menyebutkan apakah senyawa tersebut terdiri atas molekul; contohnya, natrium klorida (garam dapur, NaCl adalah senyawa ionik.
Senyawa dapat wujud dalam beberapa fase. Kebanyakan senyawa dapat berupa zat padat. Senyawa molekuler dapat juga berupa cairan atau gas. Semua senyawa akan terurai menjadi senyawa yang lebih kecil atau atom individual bila dipanaskan sampai suhu tertentu (yang disebut suhu penguraian).
Setiap senyawa kimia yang telah dijelaskan dalam literatur memiliki nomor pengenal yang unik, yaitu nomor CAS.
Definisi umum dari basa adalah senyawa kimia yang menyerap ion hydronium ketika dilarutkan dalam air.Basa adalah lawan (dual) dari asam, yaitu ditujukan untuk unsur/senyawa kimia yang memiliki pH lebih dari 7. Kostik merupakan istilah yang digunakan untuk basa kuat. jadi kita menggunakan nama kostik soda untuk natrium hidroksida (NaOH) dan kostik postas untuk kalium hidroksida (KOH). Basa dapat dibagi menjadi basa kuat dan basa lemah. Kekuatan basa sangat tergantung pada kemampuan basa tersebut melepaskan ion OH dalam larutan dan konsentrasi larutan basa tersebut.
Beberapa Contoh Basa
| Contoh basa | Terdapat di |
|---|---|
| Alumunium hidroksida (AI[OH]3) | Deodorant dan antasida |
| Kalsium Hidroksida | Plester |
| Magnesium Hidroksida | Antasida |
| Natrium Hidroksida (NaOH) | Pembersih saluran pipa |
| Kalium Hidroksida | Pembuatan sabun |
| Ammonium Hidroksida (NH3[aq]/NH4OH) | Pelarut desinfektan |
[sunting] Sifat-sifat Basa
- Kaustik
- Rasanya pahit
- Licin seperti sabun
- Nilai pH lebih dari air suling
- Mengubah warna lakmus merah menjadi biru
- Dapat menghantarkan arus listrik
Reaksi: Kalsium Hidroksida + Asam Sulfat ————> Kalsium Sulfat + Air
Ca(OH)2 (aq) + H2SO4 ————> CaSO4(aq) + 2H2O (l)
[sunting] Basa kuat
| Bagian ini membutuhkan pengembangan |
Berikut ini adalah daftar basa kuat:
- Kalium hidroksida (KOH)
- Barium hidroksida (Ba(OH)2)
- Caesium hidroksida (CsOH)
- Natrium hidroksida (NaOH)
- Stronsium hidroksida (Sr(OH)2)
- Kalsium hidroksida (Ca(OH)2)
- Magnesium hidroksida (Mg(OH)2)
- Litium hidroksida (LiOH)
- Rubidium hidroksida (RbOH)
Asam dengan pKa lebih daru 13 dianggap sangat lemah, dan basa konjugasinya adalah basa kuat.
Beberapa basa kuat seperti kalsium hidroksida sangat tidak larut dalam air. Hal itu bukan suatu masalah – kalsium hidroksida tetap terionisasi 100% menjadi ion kalsium dan ion hidroksida. Kalsium hidroksida tetap dihitung sebagai basa kuat karena kalsium hidroksida 100% terionisasi.
Penentuan pH basa kuat Karena pH merupakan pengukuran konsentrasi ion hidrogen, bagaimana suatu larutan yang mengandung ion hidroksida dapat memiliki harga pH? Untuk memahami hal ini, kamu perlu mengetahui tentang hasil kali ion air.
Apapun itu jika merupakan air, dapat disusun suatu kesetimbangan. Dengan menggunakan versi kesetimbangan yang disederhanakan:
Melalui adanya kelebihan ion hidroksida dari, katakanlah, natrium hidroksida, masih terdapat kesetimbangan, akan tetapi posisi kesetimbangan telah bergeser ke arah kiri menurut Prinsip Le Chatelier.
Terdapat ion hidrogen yang jauh lebih sedikit dibandingkan dalam air murni, akan tetapi masih terdapat ion hidrogen. pH ditentukan melalui konsentrasi ion hidrogen tersebut.
Skema metode penentuan pH basa kuat
* Tentukan konsentrasi ion hidroksida. * Gunakan Kw untuk menentukan konsentrasi ion hidrogen. * Ubahlah konsentrasi ion hidrogen ke bentuk pH.Contoh
Untuk menentukan pH 0.500 mol dm-3 arutan natrium hidroksida:
Karena natrium hidroksida bersifat ionik, tiap mol natrium hidroksida memberikan jumlah mol ion hidroksida yang sama dalam larutan.
[OH-] = 0.500 mol dm-3
Sekarang anda dapat menggunakan harga Kw pada temperatur larutan. Biasanya menggunakan 1.00 x 10-14 mol2 dm-6.
[H+] [OH-] = 1.00 x 10-14
Hal ini benar apakah air tersebut murni atau tidak. Pada kasus ini anda memiliki harga konsentrasi ion hidroksida. Substitusi konsentrasi ion hidroksida memberikan:
[H+] x 0.500 = 1.00 x 10-14
Jika anda memecahkan harga untuk [H+], dan kemudian mengubahmya pada pH, anda memperoleh pH 13.7.
[sunting] Basa lemah
Basa lemahPenjelasan istilah “basa lemah”
Amonia adalah basa lemah yang khas. Sudah sangat jelas amonia tidak mengandung ion hidroksida, tetapi amonia bereaksi dengan air untuk menghasilkan ion amonium dan ion hidroksida.
Akan tetapi, reaksi berlangsung reversibel, dan pada setiap saat sekitar 99% amonia tetap ada sebagai molekul amonia. Hanya sekitar 1% yang menghasilkan ion hidroksida.
Basa lemah adalah salah satu yang tidak berubah seluruhnya menjadi ion hidroksida dalam larutan.
Membandingkan kekuatan basa dalam larutan: Kb
Ketika basa lemah bereaksi dengan air, posisi kesetimbangan bervariasi antara basa yang satu dengan basa yang lain. Selanjutnya bergeser ke kiri, ke basa yang lebih lemah.
anda dapat memperoleh pengukuran posisi kesetimbangan melalui penulisan tetapan kesetimbangan untuk reaksi. Harga tetapan yang lebih rendah, kesetimbangan lebih bergeser ke arah kiri.
Pada kasus ini tetapan kesetimbangan disebut dengan Kb. Kb didefinisikan sebagai:
pKb
Hubungan antara Kb dan pKb persis sama seperti istilah “p” yang lain pada topik ini:
Tabel menunjukkan beberapa harga Kb dan pKb untuk beberapa basa lemah. base Kb (mol dm-3) pKb C6H5NH2 4.17 x 10-10 9.38 NH3 1.78 x 10-5 4.75 CH3NH2 4.37 x 10-4 3.36 CH3CH2NH2 5.37 x 10-4 3.27
Seiring dengan menurunnya posisi basa pada tabel, harga Kb naik. Hal ini berarti bahwa basa menjadi lebih kuat.
Seiring dengan didapatkannya Kb yang lebih besar, pKb menjadi lebih kecil. Harga pKb yang lebih rendah, basa lebih kuat.
Hal ini persis sejalan dengan hubungan untuk asam, pKa – harga yang lebih kecil, asam lebih kuat
Asam
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
| | Artikel ini tidak memiliki referensi sumber tepercaya sehingga isinya tidak bisa diverifikasi. Bantulah memperbaiki artikel ini dengan menambahkan referensi yang layak. Artikel yang tidak dapat diverifikasikan dapat dihapus sewaktu-waktu oleh Pengurus. Tag ini diberikan tanggal 13 Agustus 2009 |
| | Ada usul agar Asam kuat digabungkan ke artikel atau bagian ini. (Diskusikan) |
- Untuk nama buah atau pohon, lihat: Asam (tumbuhan), sedangkan untuk negara bagian di India, lihat: Assam.
Daftar isi[sembunyikan] |
[sunting] Berbagai definisi asam
Istilah "asam" merupakan terjemahan dari istilah yang digunakan untuk hal yang sama dalam bahasa-bahasa Eropa seperti acid (bahasa Inggris), zuur (bahasa Belanda), atau Säure (bahasa Jerman) yang secara harfiah berhubungan dengan rasa masam. Dalam kimia, istilah asam memiliki arti yang lebih khusus. Terdapat tiga definisi asam yang umum diterima dalam kimia, yaitu definisi Arrhenius, Brønsted-Lowry, dan Lewis.- Arrhenius: Menurut definisi ini, asam adalah suatu zat yang meningkatkan konsentrasi ion hidronium (H3O+) ketika dilarutkan dalam air. Definisi yang pertama kali dikemukakan oleh Svante Arrhenius ini membatasi asam dan basa untuk zat-zat yang dapat larut dalam air.
- Brønsted-Lowry: Menurut definisi ini, asam adalah pemberi proton kepada basa. Asam dan basa bersangkutan disebut sebagai pasangan asam-basa konjugat. Brønsted dan Lowry secara terpisah mengemukakan definisi ini, yang mencakup zat-zat yang tak larut dalam air (tidak seperti pada definisi Arrhenius).
- Lewis: Menurut definisi ini, asam adalah penerima pasangan elektron dari basa. Definisi yang dikemukakan oleh Gilbert N. Lewis ini dapat mencakup asam yang tak mengandung hidrogen atau proton yang dapat dipindahkan, seperti besi(III) klorida. Definisi Lewis dapat pula dijelaskan dengan teori orbital molekul. Secara umum, suatu asam dapat menerima pasangan elektron pada orbital kosongnya yang paling rendah (LUMO) dari orbital terisi yang tertinggi (HOMO) dari suatu basa. Jadi, HOMO dari basa dan LUMO dari asam bergabung membentuk orbital molekul ikatan.
Sistem asam/basa berbeda dengan reaksi redoks; tak ada perubahan bilangan oksidasi dalam reaksi asam-basa.
[sunting] Sifat-sifat
Secara umum, asam memiliki sifat sebagai berikut:- Rasa: masam ketika dilarutkan dalam air.
- Sentuhan: asam terasa menyengat bila disentuh, dan dapat merusak kulit, terutama bila asamnya asam pekat.
- Kereaktifan: asam bereaksi hebat dengan kebanyakan logam, yaitu korosif terhadap logam.
- Hantaran listrik: asam, walaupun tidak selalu ionik, merupakan cairan elektrolit.
[sunting] Sifat kimia
Dalam air, reaksi kesetimbangan berikut terjadi antara suatu asam (HA) dan air, yang berperan sebagai basa,HA + H2O ↔ A- + H3O+
Tetapan asam adalah tetapan kesetimbangan untuk reaksi HA dengan air:
![K_a = \frac{[\mbox{H}_{3}\mbox{O}^+][ \mbox{A}^-]}{[\mbox{HA}]}](http://upload.wikimedia.org/wikipedia/id/math/4/7/5/475736351c84694f7cd757136735c907.png)
Asam kuat mempunyai nilai Ka yang besar (yaitu, kesetimbangan reaksi berada jauh di kanan, terdapat banyak H3O+; hampir seluruh asam terurai). Misalnya, nilai Ka untuk asam klorida (HCl) adalah 107.
Asam lemah mempunyai nilai Ka yang kecil (yaitu, sejumlah cukup banyak HA dan A- terdapat bersama-sama dalam larutan; sejumlah kecil H3O+ ada dalam larutan; asam hanya terurai sebagian). Misalnya, nilai Ka untuk asam asetat adalah 1,8 × 10-5.
Asam kuat mencakup asam halida - HCl, HBr, dan HI. (Tetapi, asam fluorida, HF, relatif lemah.) Asam-asam okso, yang umumnya mengandung atom pusat ber-bilangan oksidasi tinggi yang dikelilingi oksigen, juga cukup kuat; mencakup HNO3, H2SO4, dan HClO4. Kebanyakan asam organik merupakan asam lemah.
Larutan asam lemah dan garam dari basa konjugatnya membentuk larutan penyangga.
[sunting] Sejarah
Sekitar tahun 1800, banyak kimiawan Prancis, termasuk Antoine Lavoisier, secara keliru berkeyakinan bahwa semua asam mengandung oksigen. Lavoisier mendefinisikan asam sebagai zat mengandung oksigen karena pengetahuannya akan asam kuat hanya terbatas pada asam-asam okso dan karena ia tidak mengetahui komposisi sesungguhnya dari asam-asam halida, HCl, HBr, dan HI. Lavoisier-lah yang memberi nama oksigen dari kata bahasa Yunani yang berarti "pembentuk asam". Setelah unsur klorin, bromin, dan iodin teridentifikasi dan ketiadaan oksigen dalam asam-asam halida ditemukan oleh Sir Humphry Davy pada tahun 1810, definisi oleh Lavoisier tersebut harus ditinggalkan.Kimiawan Inggris pada waktu itu, termasuk Humphry Davy, berkeyakinan bahwa semua asam mengandung hidrogen. Kimiawan Swedia Svante Arrhenius lalu menggunakan landasan ini untuk mengembangkan definisinya tentang asam. Ia mengemukakan teorinya pada tahun 1884.
Pada tahun 1923, Johannes Nicolaus Brønsted dari Denmark dan Martin Lowry dari Inggris masing-masing mengemukakan definisi protonik asam-basa yang kemudian dikenal dengan nama kedua ilmuwan ini. Definisi yang lebih umum diajukan oleh Lewis pada tahun yang sama, menjelaskan reaksi asam-basa sebagai proses transfer pasangan elektron.
[sunting] Penggunaan asam
Asam memiliki berbagai kegunaan. Asam sering digunakan untuk menghilangkan karat dari logam dalam proses yang disebut "pengawetasaman" (pickling). Asam dapat digunakan sebagai elektrolit di dalam baterai sel basah, seperti asam sulfat yang digunakan di dalam baterai mobil. Pada tubuh manusia dan berbagai hewan, asam klorida merupakan bagian dari asam lambung yang disekresikan di dalam lambung untuk membantu memecah protein dan polisakarida maupun mengubah proenzim pepsinogen yang inaktif menjadi enzim pepsin. Asam juga digunakan sebagai katalis; misalnya, asam sulfat sangat banyak digunakan dalam proses alkilasi pada pembuatan bensin.Asam sulfat
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
| Asam sulfat | |
|---|---|
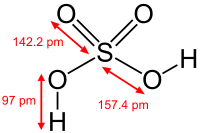 | |
 | |
| Identifikasi | |
| Nomor CAS | [7664-93-9] |
| Nomor EINECS | |
| Nomor RTECS | WS5600000 |
| Sifat | |
| Rumus molekul | H2SO4 |
| Massa molar | 98,08 g/mol |
| Penampilan | cairan bening, tak berwarna, tak berbau |
| Densitas | 1,84 g/cm3, cair |
| Titik leleh | |
| Titik didih | |
| Kelarutan dalam air | tercampur penuh |
| Keasaman (pKa) | −3 |
| Viskositas | 26,7 cP (20 °C) |
| Bahaya | |
| MSDS | ICSC 0362 |
| Klasifikasi EU | Korosif (C) |
| Indeks EU | 016-020-00-8 |
| NFPA 704 | |
| Frasa-R | R35 |
| Frasa-S | (S1/2), S26, S30, S45 |
| Titik nyala | tak ternyalakan |
| Senyawa terkait | |
| Asam kuat terkait | Asam selenat Asam klorida Asam nitrat |
| Senyawa terkait | Asam sulfit Asam peroksimonosulfat Sulfur trioksida Oleum |
| Kecuali dinyatakan sebaliknya, data di atas berlaku pada temperatur dan tekanan standar (25°C, 100 kPa) Sangkalan dan referensi | |
Daftar isi[sembunyikan] |
[sunting] Keberadaan
Asam sulfat murni yang tidak diencerkan tidak dapat ditemukan secara alami di bumi oleh karena sifatnya yang higroskopis. Walaupun demikian, asam sulfat merupakan komponen utama hujan asam, yang terjadi karena oksidasi sulfur dioksida di atmosfer dengan keberadaan air (oksidasi asam sulfit). Sulfur dioksida adalah produk sampingan utama dari pembakaran bahan bakar seperti batu bara dan minyak yang mengandung sulfur (belerang).Asam sulfat terbentuk secara alami melalui oksidasi mineral sulfida, misalnya besi sulfida. Air yang dihasilkan dari oksidasi ini sangat asam dan disebut sebagai air asam tambang. Air asam ini mampu melarutkan logam-logam yang ada dalam bijih sulfida, yang akan menghasilkan uap berwarna cerah yang beracun. Oksidasi besi sulfida pirit oleh oksigen molekuler menhasilkan besi(II), atau Fe2+:
- 2 FeS2 + 7 O2 + 2 H2O → 2 Fe2+ + 4 SO42− + 4 H+
- 4 Fe2+ + O2 + 4 H+ → 4 Fe3+ + 2 H2O
- Fe3+ + 3 H2O → Fe(OH)3 + 3 H+
[sunting] Asam sulfat di luar angkasa
[sunting] Atmosfer Venus
Asam sulfat diproduksi di atmosfer bagian atas Venus dari karbon dioksida, sulfur dioksida, dan uap air secara fotokimia oleh cahaya matahari. Foton ultraviolet dengan panjang gelombang kurang dari 169 nm dapat mengakibatkan fotodisosiasi karbon dioksida menjadi karbon monoksida dan oksigen atomik.Oksigen atomik sangatlah reaktif. Ketika ia bereaksi dengan sulfur dioksida yang merupakan sekelumit bagian dari atmosfer Venus, sulfur trioksida dihasilkan, dan ketika bergabung dengan air, akan menghasilkan asam sulfat.
- CO2 → CO + O
- SO2 + O → SO3
- SO3 + H2O → H2SO4
Atmosfer Venus menunjukkan adanya siklus asam sulfat. Setelah tetesan hujan asam sulfat jatuh ke lapisan atmosfer yang lebih panas, asam sulfat akan dipanaskan dan melepaskan uap air, sehingga asam sulfat tersebut menjadi lebih pekat. Ketika mencapai temperatur di atas 300 °C, asam sulfat mulai berdekomposisi menjadi sulfur trioksida dan air (dalam fase gas). Sulfur trioksida sangatlah reaktif dan berdisosiasi menjadi sulfur dioksida dan oksigen atomik, yang akan kemudian mengoksidasi karbon monoksida menjadi karbon dioksida.
Sulfur dioksida dan uap air kemudian naik secara arus konveksi dari lapisan tengah atmosfer menuju lapisan atas, di mana keduanya akan diubah kembali lagi menjadi asam sulfat, dan siklus ini kemudian berulang.
[sunting] Pada permukaan es Europa
Spektrum inframerah dari misi Galileo NASA menunjukkan adanya absorpsi khusus pada satelit Yupiter Europa yang mengindikasikan adanya satu atau lebih hidrat asam sulfat. Interpretasi spektrum ini kontroversial. Beberapa ilmuwan planet lebih condong menginterpretasikan spektrum ini sebagai ion sulfat, kemungkinan sebagai bagian dari mineral Europa.[1][sunting] Pembuatan
Asam sulfat diproduksi dari belerang, oksigen, dan air melalui proses kontak.Pada langkah pertama, belerang dipanaskan untuk mendapatkan sulfur dioksida:
- S (s) + O2 (g) → SO2 (g)
- 2 SO2 + O2(g) → 2 SO3 (g) (dengan keberadaan V2O5)
- H2SO4 (l) + SO3 → H2S2O7 (l)
- H2S2O7 (l) + H2O (l) → 2 H2SO4 (l)
- SO3(g) + H2O (l) → H2SO4(l)
[sunting] Sifat-sifat fisika
[sunting] Bentuk-bentuk asam sulfat
Walaupun asam sulfat yang mendekati 100% dapat dibuat, ia akan melepaskan SO3 pada titik didihnya dan menghasilkan asam 98,3%. Asam sulfat 98% lebih stabil untuk disimpan, dan merupakan bentuk asam sulfat yang paling umum. Asam sulfat 98% umumnya disebut sebagai asam sulfat pekat. Terdapat berbagai jenis konsentrasi asam sulfat yang digunakan untuk berbagai keperluan:- 10%, asam sulfat encer untuk kegunaan laboratorium,
- 33,53%, asam baterai,
- 62,18%, asam bilik atau asam pupuk,
- 73,61%, asam menara atau asam glover,
- 97%, asam pekat.
Apabila SO3(g) dalam konsentrasi tinggi ditambahkan ke dalam asam sulfat, H2S2O7 akan terbentuk. Senyawa ini disebut sebagai asam pirosulfat, asam sulfat berasap, ataupun oleum. Konsentrasi oleum diekspresikan sebagai %SO3 (disebut %oleum) atau %H2SO4 (jumlah asam sulfat yang dihasilkan apabila H2O ditambahkan); konsentrasi yang umum adalah 40% oleum (109% H2SO4) dan 65% oleum (114,6% H2SO4). H2S2O7 murni terdapat dalam bentuk padat dengan titik leleh 36 °C.
Asam sulfat murni berupa cairan bening seperti minyak, dan oleh karenanya pada zaman dahulu ia dinamakan 'minyak vitriol'.
[sunting] Polaritas dan konduktivitas
H2SO4 anhidrat adalah cairan yang sangat polar. Ia memiliki tetapan dielektrik sekitar 100. Konduktivitas listriknya juga tinggi. Hal ini diakibatkan oleh disosiasi yang disebabkan oleh swa-protonasi, disebut sebagai autopirolisis.[3]- 2 H2SO4 → H3SO4+ + HSO4−
- Kap(25 °C)= [H3SO4+][HSO4−] = 2,7 × 10−4.
Walaupun asam ini memiliki viskositas yang cukup tinggi, konduktivitas efektif ion H3SO4+ dan HSO4− tinggi dikarenakan mekanisme ulang alik proton intra molekul, menjadikan asam sulfat sebagai konduktor yang baik. Ia juga merupakan pelarut yang baik untuk banyak reaksi.
Kesetimbangan kimiawi asam sulfat sebenarnya lebih rumit daripada yang ditunjukkan di atas; 100% H2SO4 mengandung beragam spesi dalam kesetimbangan (ditunjukkan dengan nilai milimol per kg pelarut), yaitu: HSO4− (15,0), H3SO4+ (11,3), H3O+ (8,0), HS2O7− (4,4), H2S2O7 (3,6), H2O (0,1).[3]
[sunting] Sifat-sifat kimia
[sunting] Reaksi dengan air
Reaksi hidrasi asam sulfat sangatlah eksotermik. Selalu tambahkan asam ke dalam air daripada air ke dalam asam. Air memiliki massa jenis yang lebih rendah daripada asam sulfat dan cenderung mengapung di atasnya, sehingga apabila air ditambahkan ke dalam asam sulfat pekat, ia akan dapat mendidih dan bereaksi dengan keras. Reaksi yang terjadi adalah pembentukan ion hidronium:- H2SO4 + H2O → H3O+ + HSO4-
- HSO4- + H2O → H3O+ + SO42-
- (C6H12O6)n → 6n C + 6n H2O
[sunting] Reaksi lainnya
Sebagai asam, asam sulfat bereaksi dengan kebanyakan basa, menghasilkan garam sulfat. Sebagai contoh, garam tembaga tembaga(II) sulfat dibuat dari reaksi antara tembaga(II) oksida dengan asam sulfat:- CuO + H2SO4 → CuSO4 + H2O
- H2SO4 + CH3COONa → NaHSO4 + CH3COOH
Asam sulfat bereaksi dengan kebanyakan logam via reaksi penggantian tunggal, menghasilkan gas hidrogen dan logam sulfat. H2SO4 encer menyerang besi, aluminium, seng, mangan, magnesium dan nikel. Namun reaksi dengan timah dan tembaga memerlukan asam sulfat yang panas dan pekat. Timbal dan tungsten tidak bereaksi dengan asam sulfat. Reaksi antara asam sulfat dengan logam biasanya akan menghasilkan hidrogen seperti yang ditunjukkan pada persamaan di bawah ini. Namun reaksi dengan timah akan menghasilkan sulfur dioksida daripada hidrogen.
- Fe (s) + H2SO4 (aq) → H2 (g) + FeSO4 (aq)
- Sn (s) + 2 H2SO4 (aq) → SnSO4 (aq) + 2 H2O (l) + SO2 (g)
Asam sulfat menjalani reaksi substitusi aromatik elektrofilik dengan senyawa-senyawa aromatik, menghasilkan asam sulfonat terkait:[4]
[sunting] Kegunaan
Asam sulfat merupakan komoditas kimia yang sangat penting, dan sebenarnya pula, produksi asam sulfat suatu negara merupakan indikator yang baik terhadap kekuatan industri negara tersebut.[5] Kegunaan utama (60% dari total produksi di seluruh dunia) asam sulfat adalah dalam "metode basah" produksi asam fosfat, yang digunakan untuk membuat pupuk fosfat dan juga trinatrium fosfat untuk deterjen. Pada metode ini, batuan fosfat digunakan dan diproses lebih dari 100 juta ton setiap tahunnya. Bahan-bahan baku yang ditunjukkan pada persamaan di bawah ini merupakan fluorapatit, walaupun komposisinya dapat bervariasi. Bahan baku ini kemudian diberi 93% asam suflat untuk menghasilkan kalsium sulfat, hidrogen fluorida (HF), dan asam fosfat. HF dipisahan sebagai asam fluorida. Proses keseluruhannya dapat ditulis:- Ca5F(PO4)3 + 5 H2SO4 + 10 H2O → 5 CaSO4•2 H2O + HF + 3 H3PO4
Amonium sulfat, yang merupakan pupuk nitrogen yang penting, umumnya diproduksi sebagai produk sampingan dari kilang pemroses kokas untuk produksi besi dan baja. Mereaksikan amonia yang dihasilkan pada dekomposisi termal batu bara dengan asam sulfat bekas mengijinkan amonia dikristalkan keluar sebagai garam (sering kali berwarna coklat karena kontaminasi besi) dan dijual kepada industri agrokimia.
Kegunaan asam sulfat lainnya yang penting adalah untuk pembuatan aluminium sulfat. Alumunium sulfat dapat bereaksi dengan sejumlah kecil sabun pada serat pulp kertas untuk menghasilkan aluminium karboksilat yang membantu mengentalkan serat pulp menjadi permukaan kertas yang keras. Aluminium sulfat juga digunakan untuk membuat aluminium hidroksida. Aluminium sulfat dibuat dengan mereaksikan bauksit dengan asam sulfat:
- Al2O3 + 3 H2SO4 → Al2(SO4)3 + 3 H2O
[sunting] Siklus sulfur-iodin
Siklus sulfur-iodin merupakan sederet proses termokimia yang digunakan untuk mendapatkan hidrogen. Ia terdiri dari tiga reaksi kimia yang keseluruhan reaktannya adalah air dan keseluruhan produknya adalah hidrogen dan oksigen.-
2 H2SO4 → 2 SO2 + 2 H2O + O2 (830 °C) I2 + SO2 + 2 H2O → 2 HI + H2SO4 (120 °C) 2 HI → I2 + H2 (320 °C)
[sunting] Sejarah
Alkimiawan abad ke-8 Abu Musa Jabir bin Hayyan (Geber) dipercayai sebagai penemu asam sulfat. Asam ini kemudian dikaji oleh alkimiawan dan dokter Persia abad ke-9 Ar-Razi (Rhazes), yang mendapatkan zat ini dari distilasi kering mineral yang mengandung besi(II) sulfat heptahidrat, FeSO4 • 7H2O, dan tembaga(II) sulfat pentahidrat, CuSO4 • 5H2O. Ketika dipanaskan, senyawa-senyawa ini akan terurai menjadi besi(II) oksida dan tembaga(II) oksida, melepaskan air beserta sulfur trioksida yang akan bergabung menjadi larutan asam sulfat. Metode ini dipopulerkan di Eropa melalui terjemahan-terjamahan buku-buku Arab dan Persia.Asam sulfat dikenal oleh alkimiawan Eropa abad pertengahan sebagai minyak vitriol. Kata vitriol berasal dari bahasa Latin vitreus yang berarti 'gelas', merujuk pada penampilan garam sulfat yang seperti gelas, disebut sebagai garam vitriol. Garam-garam ini meliputi tembaga(II) sulfat (vitriol biru), seng sulfat (vitriol putih), besi(II) sulfat (vitriol hijau), besi(III) sulfat (vitriol Mars), dan kobalt(II) sulfat (vitriol merah).
Garam-garam vitriol tersebut merupakan zat yang paling penting dalam alkimia, yang digunakan untuk menemukan batu filsuf. Vitriol yang sangat murni digunakan sebagai media reaksi zat-zat lainnya. Hal ini dikarenakan asam vitriol tidak bereaksi dengan emas. Pentingnya vitriol dalam alkimia terlihat pada moto alkimia Visita Interiora Terrae Rectificando Invenies Occultum Lapidem ('Kunjungi bagian dalam bumi dan murnikanlah, anda akan menemukan batu rahasia') yang ditemukan dalam L'Azoth des Philosophes karya alkimiawan abad ke-15 Basilius Valentinus, .
Pada abad ke-17, kimiawan Jerman Belanda Johann Glauber membuat asam sulfat dengan membakar sulfur bersamaan dengan kalium nitrat, KNO3, dengan keberadaan uap. Kalium nitrat tersebut terurai dan mengoksidasi sulfur menjadi SO3, yang akan bergabung dengan air membentuk asam sulfat. Pada tahun 1736, Joshua Ward, ahli farmasi London, menggunakan metode ini untuk memulai produksi asam sulfat berskala besar.
Pada tahun 1746 di Birmingham, John Roebuck mengadaptasikan metode ini ke dalam suatu bilik, yang dapat menghasilkan asam sulfat lebih banyak. Proses ini disebut sebagai proses bilik, yang mengijinkan produksi asam sulfat secara efektif. Setelah berbagai perbaikan, metode ini menjadi proses standar produksi asam sulfat selama hampir dua abad.
Pada tahun 1831, saudagar asam cuka Britania Peregrine Phillips mematenkan proses kontak, yang lebih ekonomis dalam memproduksi sulfur trioksida dan asam sulfat. Sekarang, hampir semua produksi asam sulfat dunia menggunakan proses ini.
[sunting] Keselamatan
[sunting] Bahaya laboratorium
Sifat-sifat asam sulfat yang korosif diperburuk oleh reaksi eksotermiknya dengan air. Luka bakar akibat asam sulfat berpotensi lebih buruk daripada luka bakar akibat asam kuat lainnya, hal ini dikarenakan adanya tambahan kerusakan jaringan dikarenakan dehidrasi dan kerusakan termal sekunder akibat pelepasan panas oleh reaksi asam sulfat dengan air.Bahaya akan semakin meningkat seiring dengan meningkatnya konsentrasi asam sulfat. Namun, bahkan asam sulfat encer (sekitar 1 M, 10%) akan dapat mendehidrasi kertas apabila tetesan asam sulfat tersebut dibiarkan dalam waktu yang lama. Oleh karenanya, larutan asam sulfat yang sama atau lebih dari 1,5 M diberi label "CORROSIVE" (korosif), manakala larutan lebih besar dari 0,5 M dan lebih kecil dari 1,5 M diberi label "IRRITANT" (iritan). Asam sulfat berasap (oleum) tidaklah dianjurkan untuk digunakan dalam sekolah oleh karena bahaya keselamatannya yang sangat tinggi.
Perawatan pertama yang standar dalam menangani tumpahnya asam sulfat ke kulit adalah dengan membilas kulit tersebut dengan air sebanyak-banyaknya. Pembilasan dilanjutkan selama 10 sampai 15 menit untuk mendinginkan jaringan disekitar luka bakar asam dan untuk menghindari kerusakan sekunder. Pakaian yang terkontaminasi oleh asam sulfat harulah dilepaskan dengan segera dan segera bilas kulit yang berkontak dengan pakaian tersebut.
Pembuatan asam sulfat encer juga berbahaya oleh karena pelepasan panas selama proses pengenceran. Asam sulfat pekat haruslah selalu ditambahkan ke air, dan bukannya sebaliknya. Penambahan air ke asam sulfat pekat dapat menyebabkan tersebarnya aerosol asam sulfat dan bahkan dapat menyebabkan ledakan. Pembuatan larutan lebih dari 6 M (35%) adalah yang paling berbahaya, karena panas yang dihasilkan cukup panas untuk mendidihkan asam encer tersebut.
[sunting] Bahaya industri
Walaupun asam sulfat tidak mudah terbakar, kontak dengan logam dalam kasus tumpahan asam dapat menyebabkan pelepasan gas hidrogen. Penyebaran aerosol asam dan gas sulfur dioksida menambah bahaya kebakaran yang melibatkan asam sulfat.Asam sulfat dianggap tidak beracun selain bahaya korosifnya. Resiko utama asam sulfat adalah kontak dengan kulit yang menyebabkan luka bakar dan penghirupan aerosol asap. Paparan dengan aerosol asam pada konsentrasi tinggi akan menyebabkan iritasi mata, saluran pernafasan, dan membran mukosa yang parah. Iritasi akan mereda dengan cepat setelah paparan, walaupun terdapat risiko edema paru apabila kerusakan jaringan lebih parah. Pada konsentrasi rendah, simtom-simtom akibat paparan kronis aerosol asam sulfat yang paling umumnya dilaporkan adalah pengikisan gigi. Indikasi kerusakan kronis saluran pernafasan masih belum jelas. Di Amerika Serikat, batasan paparan yang diperbolehkan ditetapkan sebagai 1 mg/m³. Terdapat pula laporan bahwa penelanan asam sulfat menyebabkan defisiensi vitamin B12 dengan degenarasi gabungan subakut.
[sunting] Pembatasan hukum
Perdagangan internasional asam sulfat dikontrol oleh Konvensi Perserikatan Bangsa-Bangsa Tentang Pemberantasan Peredaran Gelap Narkotika dan Psikotropika tahun 1988, yang meletakkan asam sulfat di Tabel II konvensi tersebut sebagai bahan kimia yang sering diguakan dalam produksi gelap narkotika ataupun psikotropika.[6] Di Indonesia, konvensi ini disahkan oleh Undang-Undang Dasar Nomor 7 Tahun 1997. [7]Hujan asam adalah hujan atau bentuk lain dari presipitasi yang umumnya bersifat asam. Fenomena ini memiliki efek buruk terhadap tumbuhan, hewan air dan infrastruktur. Hujan asam umumnya disebabkan oleh emisi senyawa belerang dan nitrogen yang bereaksi di atmosfer membentuk asam. Dalam tahun-tahun terakhir, banyak pemerintahan yang telah membuat berbagai peraturan untuk mengurangi emisi-emisi tersebut.
Senyawa organik
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
Senyawa organik adalah golongan besar senyawa kimia yang molekulnya mengandung karbon, kecuali karbida, karbonat, dan oksida karbon. Studi mengenai senyawaan organik disebut kimia organik. Banyak di antara senyawaan organik, seperti protein, lemak, dan karbohidrat, merupakan komponen penting dalam biokimia.
Di antara beberapa golongan senyawaan organik adalah senyawa alifatik, rantai karbon yang dapat diubah gugus fungsinya; hidrokarbon aromatik, senyawaan yang mengandung paling tidak satu cincin benzena; senyawa heterosiklik yang mencakup atom-atom nonkarbon dalam struktur cincinnya; dan polimer, molekul rantai panjang gugus berulang.
Pembeda antara kimia organik dan anorganik adalah ada/tidaknya ikatan karbon-hidrogen. Sehingga, asam karbonat termasuk anorganik, sedangkan asam format, asam lemak pertama, organik.
Nama "organik" merujuk pada sejarahnya, pada abad ke-19, yang dipercaya bahwa senyawa organik hanya bisa dibuat/disintesis dalam tubuh organisme melalui vis vitalis - life-force.
Kebanyakan senyawaan kimia murni dibuat secara artifisial.
Kimia organik
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas

Struktur dari molekul metana: ikatan hidrokarbon yang paling sederhana.
Definisi asli dari kimia organik ini berasal dari kesalahpahaman bahwa semua senyawa organik pasti berasal dari organisme hidup, namun telah dibuktikan bahwa ada beberapa perkecualian. Bahkan sebenarnya, kehidupan juga sangat bergantung pada kimia anorganik; sebagai contoh, banyak enzim yang mendasarkan kerjanya pada logam transisi seperti besi dan tembaga, juga gigi dan tulang yang komposisinya merupakan campuran dari senyama organik maupun anorganik. Contoh lainnya adalah larutan HCl, larutan ini berperan besar dalam proses pencernaan makanan yang hampir seluruh organisme (terutama organisme tingkat tinggi) memakai larutan HCl untuk mencerna makanannya, yang juga digolongkan dalam senyawa anorganik. Mengenai unsur karbon, kimia anorganik biasanya berkaitan dengan senyawa karbon yang sederhana yang tidak mengandung ikatan antar karbon misalnya oksida, garam, asam, karbid, dan mineral. Namun hal ini tidak berarti bahwa tidak ada senyawa karbon tunggal dalam senyawa organik misalnya metan dan turunannya.
[sunting] Sejarah
Kimia organik sebagai suatu ilmu secara umum disetujui telah dimulai pada tahun 1828 dengan sintesis urea organik oleh Friedrich Woehler, yang secara tidak sengaja menguapkan larutan amonium sianat NH4OCN.Garam (kimia)
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
Dalam ilmu kimia, garam adalah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion), sehingga membentuk senyawa netral (tanpa bermuatan). Garam terbentuk dari hasil reaksi asam dan basa. Komponen kation dan anion ini dapat berupa senyawa anorganik seperti klorida (Cl−), dan bisa juga berupa senyawa organik seperti asetat (CH3COO−) dan ion monoatomik seperti fluorida (F−), serta ion poliatomik seperti sulfat (SO42−). Natrium klorida (NaCl), bahan utama garam dapur adalah suatu garam.Ada banyak macam-macam garam. Garam yang terhidrolisa dan membentuk ion hidroksida ketika dilarutkan dalam air maka dinamakan garam basa. Garam yang terhidrolisa dan membentuk ion hidronium di air disebut sebagai garam asam. Garam netral adalah garam yang bukan garam asam maupun garam basa. Larutan Zwitterion mempunyai sebuah anionik dan kationik di tengah di molekul yang sama, tapi tidak disebut sebagai garam. Contohnya adalah asam amino, metabolit, peptida, dan protein.
Larutan garam dalam air (Misalnya natrium klorida dalam air) merupakan larutan elektrolit, yaitu larutan yang dapat menghantarkan arus listrik. Cairan dalam tubuh makhluk hidup mengandung larutan garam, misalnya sitoplasma dan darah. Tapi, karena cairan dalam tubuh ini juga mengandung banyak ion-ion lainnya, maka tidak akan membentuk garam setelah airnya diuapkan.
Daftar isi[sembunyikan] |
[sunting] Ciri-ciri
[sunting] Warna
Garam dapat berwarna cerah dan transparan (contohnya natrium klorida), Buram, dan kadang juga berwarna metalik dan berkilau (Besi disulfida).Garam dapat berwarna macam-macam, seperti misalnya di bawah ini:
- kuning (natrium kromat),
- jingga (kalium dikromat),
- merah (kalium ferisianida),
- mauve (kobalt klorida heksahidrat),
- biru (tembaga sulfat pentahidrat, ferric hexacyanoferrate),
- ungu (kalium permanganat),
- hijau (nikel klorida heksahidrat),
- putih (natrium klorida/garam dapur),
- tidak berwarna (Magnesium Sulfate Heptahidrat) dan
- hitam (mangan dioksida).
[sunting] Rasa
Di semua garam, ada 5 rasa berbeda, yaitu: asin (natrium klorida), manis (timbal (II) asetat, beracun kalau sampai tertelan), asam (kalium bitartrat), pahit (magnesium sulfat), dan gurih (monosodium glutamat).[sunting] Bau
Garam yang berasal dari asam kuat dan basa kuat ("garam kuat") biasanya stabil dan tidak berbau, sedangkan garam yang terbentuk dari asam lemah maupun basa lemah ("garam lemah") lebih berbau karena disebabkan oleh asam konjugasinya (contohnya asetat (asam asetat) pada (cuka) dan sianida seperti hidrogen sianida) atau bisa juga karena basa konjugasinya (contohnya garam amonium seperti amonia). Dekomposisi parsial ini bisa dipercepat dengan penambahan air, karena hidrolisis merupakan setengah bagian lain dari reaksi reversibel yang membentuk garam lemah.[sunting] Ion
Nama-nama garam diawali dengan nama ion kation (contohnya, natrium atau amonium) diikuti dengan nama ion anion (contohnya, klorida atau asetat).Ion yang termasuk kation diantaranya:
- Amonium NH4+
- Kalsium Ca2+
- Besi Fe2+ and Fe3+
- Magnesium Mg2+
- Kalium K+
- Pyridinium C5H5NH+
- Quaternary ammonium NR4+
- Natrium Na+
- Asetat CH3COO− (asam asetat)
- Karbonat CO32− (asam karbonat)
- Klorida Cl− (asam klorida)
- Sitrat HOC(COO−)(CH2COO−)2 (asam sitrat)
- Sianida C≡N− (asam sianida)
- Hidroksida OH− (air)
- Nitrat NO3− (asam nitrat)
- Nitrit NO2− (asam nitrit)
- Oksida O2− (air)
- Fosfat PO43− (asam fosfat)
- Sulfat SO42− (asam sulfat)
[sunting] Pembentukan garam
Reaksi kimia untuk menghasilkan garam antara lain:- Reaksi antara asam dan basa, misalnya asam klorida (HCl) + amoniak (NH3) → amonium klorida (NH4Cl).
- Reaksi antara logam dan asam kuat encer, misalnya Mg + 2 HCl → MgCl2 + H2. Keterangan: logam mulia umumnya tidak bereaksi dengan cara ini.
- Reaksi antara logam dan nonlogam, misalnya, Ca + Cl2 → CaCl2
- Reaksi antara basa dan oksida asam, misalnya, 2 NaOH + Cl2O → 2 NaClO + H2O
- Reaksi antara asam dengan oksida basa, misalnya, 2 HNO3 + Na2O → 2 NaNO3 + H2O
- Garam juga dapat dibentuk apabila 2 garam yang berbeda dicampur. Ion-ion mereka akan membentuk campuran baru, misalnya:
-
- Pb(NO3)2(aq) + Na2SO4(aq) → PbSO4(s) + 2 NaNO3(aq)
Oksida
Dari Wikipedia bahasa Indonesia, ensiklopedia bebasOksida adalah senyawa kimia yang sedikitnya mengandung sebuah atom oksigen serta sedikitnya sebuah unsur lain. Sebagian besar kerak bumi terdiri atas oksida. Oksida terbentuk ketika unsur-unsur dioksidasi oleh oksigen di udara. Pembakaran hidrokarbon menghasilkan dua oksida utama karbon, karbon monoksida, dan karbon dioksida. Bahkan materi yang dianggap sebagai unsur murni pun seringkali mengandung selubung oksida. Misalnya aluminium foil memiliki kulit tipis Al2O3 yang melindungi foil dari korosi. Oksida-oksida dari unsur-unsur periode 3: Na2O MgO Al2O3 SiO2 P4O10 SO3 Cl2O7 P4O6 SO2 Cl2O Oksida-oksida pada barisan pertama dikenal sebagai oksida-oksida tertinggi dari tiap unsur. Oksida-oksida ini adalah saat di mana unsur-unsur periode 3 berada pada keadaan oksidasi tertinggi. Pada oksida-oksida ini, semua elektron terluarnya terlibat dalam pembentukkan ikatan mulai dari natrium yang hanya memiliki satu elektron terluar hingga klor dengan 7 elektron terluar. Struktur Kecenderungan pada struktur adalah dari oksida logam mengandung struktur ionik raksasa pada bagian kiri periode, oksida kovalen raksasa (silikon dioskida) pada bagian tengah dan oksida molekuler di bagian kanan periode. Titik leleh dan titik didih Struktur raksasa (oksida logam dan silikon dioksida) memiliki titik leleh dan titik didih yang tinggi karena dibutuhkan energi yang besar untuk memutuskan ikatan yang kuat (ionik atau kovalen) yang bekerja pada tiga dimensi. Oksida-oksida fosfor, sulfur dan klor terdiri dari molekul-molekul individual, beberapa di antaranya kecil dan sederhana, dan yang lainya berupa polimer. Gaya tarik menarik antar molekul-molekul ini berupa dispersi / penyebaran gaya van der Waals dan interaksi dipol-dipol. Ukuran yang bermacam-macam ini tergantung pada ukuran, bentuk dan polaritas dari masing-masing molekul, tapi akan selalu lebih lemah dari pada yang dibutuhkan untuk memutuskan ikatan ionik atau kovalen pada struktur raksasa. Oksida-oksida ini cenderung menjadi gas, cairan atau padatan dengan titik leleh rendah. Daya hantar arus listrik Tidak ada di antara oksida-oksida ini yang memiliki elektron bebas atau yang dapat bergerak. Ini berarti bahwa tidak ada satupun dari oksida-oksida ini yang dapat menghantarkan arus listrik dalam keadaan padatnya. Oksida-oksida ini dapat mengalami elektrolisis jika dicairkan. Oksida-oksida ini dapat menghantarkan arus listrik karena adanya pergerakan ion-ion menuju elektroda dan pelepasan muatan ion-ion saat mencapai elektroda. Oksida-oksida logam Struktur Oksida-oksida natrium, magnesium dan alumunium terdiri dari struktur raksasa yang mengandung ion-ion logam dan ion-ion oksida. Magnesium oksida memiliki struktur seperti NaCl. Dua yang lainnya memiliki struktur yang lebih rumit yang berada di luar cakupan silabus pada tingkat ini. Titik leleh dan titik didih Terdapat gaya tarik menarik yang kuat antara ion-ion pada masing-masing oksida dan gaya tarik menarik ini membutuhkan energi yang besar untuk diputuskan. Oleh karena itulah oksida-oksida ini memiliki titik leleh dan titik didih yang tinggi. Daya hantar arus listrik Tidak ada satupun dari oksida-oksida logam periode 3 dapat menghantarkan arus listrik pada keadaan padatnya, tapi elektrolisis mungkin dilakukan jika dicairkan. Cairannya dapat menghantarkan arus listrik karena adanya pergerakan dan perubahan muatan ion-ion yang ada. Contoh pentingnya adalah elektrolisis alumunium oksida dalam pembuatan alumunium. Apakah kita dapat mengelektrolisis cairan natrium oksida itu tergantung pada cairan / lelehannya apakah menyublim atau terurai pada keadaan biasa atau tidak. Jika menyublim, maka tak akan didapatkan cairan untuk dielektrolisis. Magnesium dan alumunium oksida memiliki titik leleh yang sangat tinggi sehingga sulit untuk dielektrolisis dalam laboratorium sederhana. Silikon dioksida (silikon (IV) oksida) Struktur Elektronegatifitas / keelektronegatifan dari unsur-unsur meningkat sepanjang periode dari kiri ke kanan, dan pada silikon, beda elektronegatifitas antara silikon dan oksigen tidak cukup besar untuk membentuk ikatan ionik. Silikon dioksida memiliki struktur kovalen raksasa.. Terdapat tiga bentuk silikon dioksida yang berbeda. Yang paling mudah diingat dan digambarkan adalah struktur yang mirip intan. Kristal silikon memiliki struktur yang sama dengan intan. Untuk mengubahnya menjadi silikon dioksida, perlu dilakukan perubahan struktur silikon dengan menyisipkan beberapa atom oksigen. Perhatikan bahwa masing-masing atom silikon dengan atom silikon tetangganya dijembatani oleh atom oksigen. Jangan lupakan bahwa ini hanya bagian kecil dari struktur raksasa dalam tiga dimensi. Titik leleh dan titik didih Silikon dioksida memiliki titik leleh yang tinggi, bermacam-macam tergantung pada strukturnya (ingat bahwa hanya satu dari tiga struktur yang mungkin), tapi angkanya sekitar 1700 °C. Ikatan kovalen silikon-oksigen yang sangat kuat harus diputuskan terlebih dahulu sebelum meleleh. Silikon dioksida mendidih pada suhu 2230 °C. Karena kita membicarakan tentang perbedaan bentuk ikatan, tidak berarti bila membandingkan nilai ini dengan oksida logam yang lain. Lebih baik menyatakan bahwa karena oksida logam dan silikon dioksida memiliki struktur raksasa, maka titik leleh dan titik didihnya tinggi. Daya hantar arus listrik Silikon dioksida tidak memiliki elektron-elektron atau ion-ion yang dapat bergerak sehingga tidak dapat menghantarkan arus listrik, baik dalam bentuk padatan maupun cairannya. Oksida molekuler Fosfor, sulfur dan klor semuanya membentuk oksida yang terdiri dari molekul-molekulnya. Beberapa dari molekul-molekul ini sederhana dan lainnya merupakan polimer. Kita hanya akan membahas molekul sederhana. Titik leleh dan titik didih dari oksida-oksida ini akan lebih rendah dari oksida logam dan silikon dioksida. Gaya intermolekuler mengikat satu molekul dengan molekul yang lain melalui dispersi gaya van der Waals atau interaksi dipol-dipol. Kekuatannya bermacam-macam tergantung pada ukuran molekulnya. Tak satupun dari oksida-oksida ini yang menghantarkan arus listrik baik sebagai padatan maupun cairannya. Tak satupun yang mengandung ion-ion atau elektron-elektron bebas. Oksida-oksida fosfor Fosfor memiliki dua oksida yang umum, fosfor (III) oksida, P4O6, dan fosfor (V) oksida, P4O10. Fosfor (III) oksida Fosfor (III) oksida adalah padatan putih, meleleh pada 24 °C dan mendidih pada 173 °C. Struktur dari molekul ini paling baik disusun dari molekul-molekul P4 yang tetrahedral. Tarik bagian ini sehingga kita akan lihat ikatannya…. … dan kemudian gantikan ikatannya dengan ikatan baru yang menghubungkan atom-atom fosfor dengan atom-atom oksigen. Ini akan membentuk V seperti pada air, tapi tidak akan disalahkan bila menggambarnya dengan garis lurus antara atom-atom fosfor, seperti contoh Fosfor hanya menggunakan tiga elektron terluar (3 elektron p yang tidak berpasangan) membentuk tiga ikatan dengan oksigen. Fosfor (V) oksida Fosfor (V) oksida juga berupa padatan putih yang dapat menyublim (berubah dari padat ke gas) pada suhu 300 °C. Dalam kasus ini, fosfor menggunakan semua elektron terluar untuk berikatan. Padatan fosfor (V) oksida berada dalam beberapa bentuk berbeda, beberapa di antaranya berbentuk polimer. Kita akan membahas bentuk molekuler sederhana dan ini juga berada dalam keadaan gas. Ini mudah digambarkan dengan menggambar P4O6 terlebih dahulu. Empat atom oksigen yang lain diikatkan pada empat atom fosfor melalui ikatan rangkap. Oksida-oksida sulfur Sulfur membentuk dua oksida yang umum, sulfur dioksida (sulfur (IV) oksida), SO2, dan sulfur trioksida (sulfur (VI) oksida), SO3. Sulfur dioksida Sulfur dioksida adalah gas yang tak berwarna pada suhu ruangan yang mudah dikenal dengan bau yang khas / mencekik. Ini terdiri dari molekul sederhana SO2 . Sulfur menggunakan empat elektron terluarnya untuk membentuk ikatan rangkap dengan oksigen, menyisakan dua elektron yang berpasangan pada sulfur. Bentuk bengkok dari SO2 adalah akibat dari adanya pasangan elektron bebas ini. Sulfur trioksida Sulfur trioksida murni merupakan padatan putih dengan titik leleh dan titik didih yang rendah. Sulfur trioksida bereaksi cepat dengan uap air di udara membentuk asam sulfat. Ini berarti bahwa jika kita membuatnya di laboratorium, maka akan tampak sebagai padatan dengan asap di udara (membentuk kabut asam sulfat). Sulfur trioksida dalam keadaan gas, terdiri dari molekul sederhana SO3 di mana semua elektron terluar dari sulfur terlibat dalam pembentukkan ikatan. Terdapat bermacam-macam bentuk sulfut trioksida. Yang paling sederhana adalah trimer, S3O9, di mana 3 molekul SO3 bergabung membentuk cincin. Terdapat bentuk polimer lainnya di mana molekul SO3 bergabung membentuk rantai panjang. Sebagai contoh: Kenyataanya molekul-molekul sederhana bergabung dengan cara ini membentuknya struktur yang lebih besar membentuk padatan SO3 Klor oksida Klor membentuk beberapa oksida. Disini kita hanya membahas dua di antaranya yaitu klor (I) oksida, Cl2O dan klor (VII) oksida, Cl2O7. Klor (I) oksida Klor (I) oksida adalah gas berwarna merah kekuningan pada suhu ruangan. Ini terdiri dari molekul ionik sederhana. Tidak ada yang mengejutkan tentang molekul ini dan sifat fisiknya hanya memperkirakan dari ukuran molekulnya. Klor (VII) oksida Dalam klor (VII) oksida, klor menggunakan 7 elektron terluarnya untuk membentuk ikatan dengan oksigen. Ini menghasilkan molekul yang lebih besar sehingga dapat diperkirakan bahwa titik leleh dan titik didihnya lebih tinggi dari pada klor (I) oksida. Klor (VII) oksida adalah cairan seperti minyak yang tak berwarna pada suhu ruangan. Pada diagram, digambarkan rumus struktur yang standar. Pada kenyataannya, bentuknya adalah tetrahedral di sekitar kedua Cl dan berbentuk V di sekitar oksigen pusat. Oksida, seperti besi oksida atau karat, Fe2O3, terbentuk ketika oksigen bergabung dengan unsur lainnya
Oksida, seperti besi oksida atau karat, Fe2O3, terbentuk ketika oksigen bergabung dengan unsur lainnya
- Pb(NO3)2(aq) + Na2SO4(aq) → PbSO4(s) + 2 NaNO3(aq)












Tidak ada komentar:
Posting Komentar